PROTEÍNAS
Uno de los tres componentes principales de los alimentos, los otros dos son los carbohidratos y las grasas. Están compuestas principalmente de carbono, hidrógeno, nitrógeno y oxígeno, en ocasiones con trazas de azufre, fósforo y otros elementos. Se encuentran en plantas y animales como parte del cartílagos, la piel, las uñas, el pelo y los músculos.
 | |
| Concepto: | Uno de los tres componentes principales de los alimentos, los otros dos son las los carbohidratos y las grasas. |
Un componente principal de los alimentos
Las proteínas forman parte de las enzimas, los anticuerpos, la sangre, la leche, la clara de huevo, etc. Son moléculas complejas, la más pequeña de las conocidas tiene una masa molecular de 5 000; las más grandes tienen masas moleculares del orden de los diez millones. Ejemplo de una proteína "sencilla" es la llamada lactoglobulina (presente en la leche) que tiene una masa molecular de sólo 42 mil y una fórmula aproximada de C(1864)H(3012) O(576) N(468) S(21).
A semejanza de los carbohidratos, las proteínas están formadas de unidades más pequeñas (en este caso los llamados aminoácidos), las cuales se unen para formar cadenas más largas. Tan sólo en las plantas se cuentan más de 100 aminoácidos identificados, sin embargo hasta la fecha sólo unos 22 han sido identificados como constituyentes de las proteínas. Los aminoácidos se emplean en la digestión para construir nuevas proteínas y tienen, como podía suponerse, un grupo ácido (llamado carboxil) -COOH y un grupo amino -NH2 o imino = NH.
Ambos grupos están unidos, junto con un átomo de hidrógeno, al mismo átomo de carbono (llamado carbono a). La diferencia entre los aminoácidos radica en la cadena R de átomos unida al grupo antes descrito.
Ejemplo de la estructura de los aminoácidos: R - (H)CN(H2) - COOH
Ejemplos de proteínas
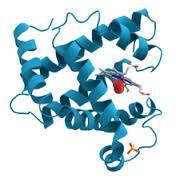
La complejidad del encadenamiento de los aminoácidos es extraordinaria: se puede tener cadenas rectas, enrolladas, dobladas; en la Figura 2 se representa esquemáticamente la hemoglobina, proteína contenida en la sangre. Al parecer los encadenamientos se logran entre los carbonos a de los aminoácidos, eliminando agua.
Las cadenas de proteínas pueden estar acomodadas paralelamente, como en la lana, el pelo o el tejido fibroso de la pechuga de pollo, o bien estar enredadas semejando una bola de estambre, como en la clara de huevo. Pueden desempeñar funciones muy diversas en el organismo; la miosina, por ejemplo, es una proteína contráctil presente en los músculos y también una enzima que hidroliza al ATP.
Figura 2. Representación esquemática de la molécula de hemoglobina.
Estructura de las proteínas
Las proteínas constituyen un grupo de sustancias muy heterogéneas, lo cual está dado por el hecho de que las moléculas proteicas son sustancias de elevada masa molar, formadas por un número variable de aminoácidos diferentes, lo que trae consigo una gran diversidad de estructuras como puede apreciarse incluso desde su clasificación.
De manera general puede plantearse que son iones dipolares anfóteros que migran en campos eléctricos y al igual que los aminoácidos tienen puntos isoeléctricos característicos.
La cadena que compone el esqueleto de las proteínas está formado por uniones amidas relativamente estables y con vistas a lograr un análisis más adecuado de su estructura se acostumbra a establecer determinados niveles de organización también denominados niveles estructurales que son:
Nivel de organización primario o estructura primaria. Nivel de organización secundario o estructura secundaria. Nivel de organización terciario o estructura terciaria. Nivel de organización cuaternario o estructura cuaternaria.
Estructura primaria
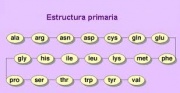
Se refiere al esqueleto covalente de la cadena polipeptídica y establece de modo específico la secuencia de sus restos aminoacídicos, es decir, el orden en que van colocándose los aminoácidos en la cadena, aspecto que está determinado genéticamente.
Las cadenas polipeptídicas están constituidas por repeticiones de una unidad básica, que son los aminoácidos, sin embargo en la cadena como tal sólo participan los átomos que forman el enlace peptídico y el átomo de carbono de manera tal que el resto de las moléculas de los aminoácidos se proyecta hacia afuera de la cadena y es lo que se conoce como restos de aminoácidos
Como el enlace peptídico es un enlace covalente, la estructura de la cadena la forma un esqueleto covalente, lo cual explica la notable estabilidad y resistencia de esta estructura.
Si se considera la unión de los aminoácidos, por ejemplo, Alanina y glicina, pudieran formarse sólo dos combinaciones: Ala-Gli y Gli-Ala Tres aminoácidos (añadiendo la Leucina pueden formar seis combinaciones: Ala. Gli. Leu; Ala. Leu. Gli; Gli, Ala, Leu; Gli. Leu. Ala; Leu. Ala. Gli; Leu. Gli. Ala.
Si se consideraran cuatro aminoácidos serían posibles 24 péptidos isómeros, 5 darían 120 y si se consideraran los 20 aminoácidos que pueden formar parte de las proteínas, pudieran construirse un número de 10 2 432 902 008 176 640 000 moléculas diferentes que tendrían una composición aminoacídica absolutamente igual pero con diferentes estructuras.
Cada aminoácido puede encontrarse en una misma molécula de proteína varias veces, entonces pudiera entenderse que aún éste número gigantesco puede ser mayor.
En 1953 Frederik Sanger (premio Nobel en 1958) descubrió la secuencia completa de la primera proteína individual de la que se conoció su fórmula química, la insulina.
La insulina es una hormona secretada por el páncreas que regula el metabolismo de la glucosa y su deficiencia produce diabetes mellitus. Las insulinas de los vertebrados tienen todas una cadena A de 21 residuos y una cadena de B de 30. Estas cadenas polipeptídicas están enlazadas por los llamados puentes de disulfuro ( S S ).
Las principales diferencias en las cadenas A de la insulina de las diferentes especies se encuentran en las posiciones 8, 9 y 10. En los humanos éstas son: Tre.Ser.Ile; en vacas sería Ala Ser.Val y en corderos Ala.Gli.Val. Estudios similares se han llevado a cabo y con ellos se han determinado las secuencias de numerosas proteínas como la lisozima (129 residuos), la ribonucleasa (124 residuos), la hemoglobina (4 cadenas: 2 alfa con 141 residuos y 2 beta con 146 residuos), el citrocromo C (el de levadura tiene 108 residuos), etcétera.
La elucidación de la estructura primaria de las proteínas es un paso de gran importancia en el estudio de estas sustancias. A modo de ejemplo podemos citar como uno de los descubrimientos más sensacionales en este campo, el del científico L. Pauling (uno de los especialistas más destacados en la química de las proteínas y uno de los creadores de la química cuántica moderna) quien logró descubrir el secreto de una enfermedad incurable y temible, la anemia drepanocítica o de Dresbach. Los eritrocitos de la sangre del hombre afectado por esta enfermedad perdían la capacidad de transportar el oxígeno. Se encontró que en los eritrocitos de las personas enfermas se encontraba la hemoglobina (proteína que transporta el O ) con una "errata" en su secuencia.
Esta errata consistía en la sustitución de un residuo de ácido glutámico por valina en la posición seis de la cadena B de esta molécula. Fue establecido entonces que la sustitución de un sólo aminoácido en la enorme molécula de proteína conduce a cambios tan serios como éste así, este científico, químico y no médico, ayudó a resolver uno de los enigmas de la medicina.
Los estudios de las diferentes secuencias conocidas hasta estos momentos han permitido establecer que las proteínas que realizan igual función en diferentes especies, tienen secuencias parecidas y éste es generalmente tanto mayor mientras más relacionadas están las especies.
El hecho de que las proteínas particulares tengan una secuencia única. confirma la aseveración de que esta secuencia es establecida genéticamente, o sea, que son los genes los que portan la información de la misma y la transmiten de una generación a otra y dado que cada especie tiene sus propias proteínas, la utilización de una proteína dada en otra especie puede acarrear reacciones serias de incompatibilidad. Esto, por ejemplo, constituye la base fundamental de los rechazos en los injertos de una especie a otra e incluso entre individuos de la misma especie.
Estructura secundaria
Se refiere al ordenamiento regular y periódico en el espacio de las cadenas polipeptídicas a lo largo de una dirección. Esta estructura es evidente sobre todo en las proteínas fibrosas, en las que las cadenas peptídicas poseen una conformación extendida o arrollada longitudinalmente y aparece también en segmentos de cadenas polipeptídicas de las proteínas globurales.
Los estudios desarrollados por Pauling, Corey y, colaboradores en la década de 1930 1940 acerca de la estructura de las proteínas y basados en la técnica de difracción de rayos X, revelaron que la cadena de polipéptido de una proteína natural puede interactuar consigo misma en dos formas principales: por formación de una "lámina plegada" o por formación de la "alfa hélice".
Para poder entender cómo ocurren estas interacciones es necesario conocer los resultados obtenidos del análisis de rayos X sobre la geometría del enlace peptídico mismo.
Los requisitos postulados por Pauling y Corey y que han sido demostrados posteriormente son los siguientes:
Los enlaces peptídicos tienden a asumir una geometría tal que los seis átomos del enlace amida sean coplanares como resultado de la resonancia.
El enlace C N de la unión amida tiene aproximadamente de 30 a 40 % de carácter de doble enlace por lo que la rotación a través de él se halla restringido requiriendo de una energía de activación del orden de 40 a 80 kJ.mol-1, mientras que las rotaciones en torno a los enlaces C C no lo están, es decir, las rotaciones de los grupos unidos al N de la amida y al C del carbonilo son relativamente libres y esto es lo que permite que las cadenas tomen diferentes conformaciones.
La distribución de los grupos alrededor del enlace amida en configuración trans es más estable que la cis debido a la interacción estérica entre los grupos de los átomos de C alfa del isómero cis.
Los planos sólo pueden girar en cierta medida unos con respecto a otros en sus puntos de unión constituidos por los carbonos alfa. La posibilidad de formación de los puentes de hidrógeno deberá ser máxima pues desempeñan un papel esencial en la estabilización de la conformación de la cadena polipeptídica. La formación de los enlaces de hidrógeno puede lograrse entre varias cadenas peptídicas que corran paralelas unas al lado de las otras.
La estructura laminar plegada le facilita suficiente espacio a los grupos R pequeños y medianos como para evitar las repulsiones de Van der Waals. Este tipo de estructura resulta de los enlaces de hidrógeno intermoleculares que se forman entre las cadenas polipeptídicas extendidas y éstos están orientados aproximadamente en forma perpendicular al eje mayor de las cadenas, las cuales a su vez pueden correr en el mismo sentido o en sentidos opuestos dando lugar a ordenamientos paralelos o antiparalelos.
En esta conformación los grupos R se proyectan por encima y por debajo de la "hoja" y son paralelos entre sí, lo que favorece la estabilidad de la estructura.
La hoja plegada se presenta en algunas queratinas presentes en escamas, b proteínas fibrosas como las picos y garras de aves reptiles, así como en algunas proteínas globulares y constituye la estructura predominante en la fibroína de la seda (48 % de residuos de glicina y 38 % de serina y alanina). Esto implica que un aminoácido si y otro no es un resto de glicina, de modo que todos los grupos R de un lado de la lámina plegada son átomos de H.
Dado que la alanina constituye la mayor parte de los restos de aminoácidos de la fibroína, la mayor parte de los grupos R del otro lado de la lámina son grupos metilos (relativamente pequeños). Si los grupos R fueran más voluminosos esta estructura no sería estable y se establecería entonces una forma helicoidal.
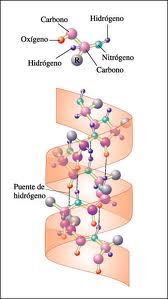
A partir de los hallazgos de Pauling y Corey sobre la geometría del enlace peptídico, estos científicos predijeron otro ordenamiento estable de la cadena polipeptídico que es la estructura de espiral, ya que permite un número máximo de enlaces de hidrógeno e introduce la mínima cantidad de distorsión tanto de la longitud como del ángulo de enlace.
La estructura de hélice se caracteriza porque la cadena peptídica se dobla formando un arrollamiento helicoidal donde los puentes de H se forman entre una espira y la siguiente y estos son paralelos al eje de la hélice.
Esta estructura helicoidal se encuentra en muchas proteínas globulares y queratinas, proteínasatambién en algunas fibrosas como la de las seapresentes en el cabello, la lana y las uñas. También la hélice encuentra presente en proteínas de características intermedias entre fibrosas y globulares como la miosina y el fibrinógeno.
No todas las cadenas de péptidos existen en forma de hélice, sino que algunas adoptan, por ejemplo, lo que se denomina una "distribución de hélices desordenadas", una estructura que es flexible, cambiante y estáticamente aleatoria.
Las cadenas de polipéptidos de las proteínas globulares como la hemoglobina, la ribonucleasa, la y segmentos deaquimotripsina y la lisozima tienen segmentos de hélice hélice desordenada. A menudo en las regiones de la estructura donde se presentan los cambios de conformación se encuentra prolina e hidroxiprolina como ya hemos mencionado.
Estructura terciaria
Se refiere al modo en que la cadena polipeptídica se curva o se pliega para formar la estructura estrechamente plegada y compacta de las proteínas globulares. Los dobleces no se presentan al azar sino que bajo las condiciones ambientales adecuadas sólo se producen en una forma específica característica de una proteína en particular que a menudo es sumamente importante para su función biológica.
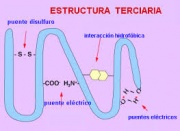
La capacidad de las cadenas polipeptídicas para formar glóbulos, es decir, el carácter de la estructura, depende de las siguientes particularidades de estas cadenas y del medio en el cual se hallan presente:
- La rigidez del enlace peptídico y su forma planar.
- La disposición del oxígeno y el hidrógeno por ambos lados del enlace peptídico (configuración trans).
- La estructura de las cadenas laterales de aminoácidos y sus cargas eléctricas.
- Las propiedades del medio ambiente, o sea, de las moléculas de agua (de la capacidad de sus moléculas de formar los puentes de hidrógeno unas con otras).
- La formación del glóbulo se explica por la redistribución de los enlaces de hidrógeno entre las moléculas de agua y las cadenas laterales de los radicales de aminoácidos en la cadena polipeptídica. Si la cadena está desplegada, las moléculas de agua se unen por los puentes de H con las cadenas laterales de los radicales de aminoácidos. La tendencia de las moléculas de agua a formar enlaces de hidrógeno unas con otras conlleva a la torsión paulatina de la cadena.
Esto trae como consecuencia que las cadenas hidrófobas de las radicales de aminoácidos se disponen dentro del glóbulo, mientras que las hidrófilas, que interaccionan con las moléculas de agua lo hacen hacia afuera, de manera tal que se forma un glóbulo estable.
En la naturaleza existen muchas proteínas que no están disueltas en agua, como es el caso de las proteínas de membranas, que funcionan rodeadas de lípidos. En estas proteínas la estructura terciaria está condicionada por la interacción de las cadenas laterales hidrófobas (o sea, las lipófilas) con los lípidos de las membranas, mientras que las cadenas laterales hidrófilas interaccionan agrupándose en el interior del glóbulo o forman regiones salientes de la membrana al medio acuoso.
El esqueleto covalente de una cadena polipeptídica posee, al menos formalmente, enlaces simples, por lo que podría esperarse que una cadena tuviera un número infinito de conformaciones posibles y además, que la conformación de cualquier polipéptido experimentara un cambio constante a causa de os movimientos térmicos. Sin embargo, las cadenas polipeptídicas de una proteína poseen solamente una conformación (o muy pocas), en condiciones normales de temperatura y de pH. Esta conformación, reconocida como conformación nativa de la proteína y que es la que le confiere actividad biológica, es suficientemente estable para que la molécula pueda ser fácilmente aislada y retenida en su estado nativo. Lo anterior implica que los enlaces simples en el esqueleto de la proteína nativa, como ya habíamos analizado, no pueden girar libremente.
El término conformación se emplea para referirse, de manera combinada a las estructuras secundarias, terciarias y cuaternarias (esta última se discutirá en breve).
Al considerar los tipos de fuerzas intermoleculares que desempeñan un papel en la determinación de las estructuras tridimensionales de las proteínas hay que considerar los siguientes:
- Fuerzas electrostáticas. Estas pueden establecerse, por ejmplo, entre el grupo amino de la lisina y los segundos grupos carboxilos de los ácidos aspártico y glutámico.
- Enlaces de hidrógeno. Estos pueden establecerse entre los grupos hidroxilos alcohólicos y fenólicos presentes en los residuos de algunos aminoácidos y los grupos carboxilos.
- Fuerzas de Van der Waals. Son interacciones dipolo dipolo; ion dipolo inducido; dipolo dipolo inducido y fuerzas de dispersión.
- Enlace hidrófobo. Los grupos de carácter apolar, en un medio acuoso, tienden a reunirse entre si para evitar el contacto con el agua. Esta tendencia de estos grupos apolares a reunirse de forma compacta y lograr una conformación de menor energía y por tanto mayor estabilidad es lo que se denomina enlace hidrófobo, unión hidrofóbica o unión apolar.
En el proceso de plegado deben considerarse además, los enlaces disulfuro (enlaces cruzados) que se establecen entre dos residuos de cisteína y que conlleva a una unión covalente que estabiliza considerablemente la estructura terciaria.
Estructura cuaternaria
Este nivel estructural de las proteínas pone de manifiesto cómo se disponen las cadenas polipeptídicas individuales de una proteína que posee más de una cadena. La mayor parte de las grandes proteínas, ya sean fibrosas o globulares contienen dos o más cadenas polipeptídicas entre las cuales pueden no existir enlaces covalentes pero que se mantienen unidas formando una unidad activa biológicamente. Se considera que cualquier proteína de masa molar superior a 50000 se hallará integrada por dos o más cadenas. A las cadenas peptídicas que poseen su propia estructura espacial se les denomina subunidades o protómeros y a la unidad formada por la unión de las mismas se les denomina oligómero.
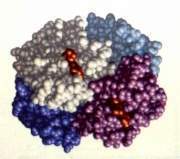
Muchas proteínas de masa molar superior a 50000 son oligómeros. Se dice que el modo característico mediante el cual las cadenas individuales polipeptídicas encajan unas con otras en la conformación nativa de una proteína oligomérica es su estructura cuaternaria.
La primera proteína con nivel cuaternario a la que se le estableció su estructura fue a la hemoglobina de caballo (M.F. Perutz y col.). El análisis de rayos X de la molécula de la hemoglobina resultó mucho más complicado que el análisis de la molécula de mioglobina, puesto que la primera es mayor y posee cuatro veces más átomos capaces de difractar.
La de 141,ahemoglobina contiene cuatro cadenas peptídicas separadas (dos de 146 restos) unidas cada una a un grupo hemo (grupobrestos y dos prostético). Las cuatro cadenas están trenzadas de forma tal que le confieren a la hemoglobina una estructura aproximadamente esférica de tienen un altob y adimensiones 6,4 x 5,5 x 5,0 nm. Las cadenas .aporcentaje de hélice
El Fe del grupo hemo está en el estado de oxidación 2+ y forma un enlace coordinado con un nitrógeno del grupo imidazol de la His de la cadena de un polipéptido similar a lo presentado en la mioglobina, lo que deja una valencia del ion ferroso libre para combinarse con el O2 tal como se presenta a continuación.
Esto explica que la función biológica de esta proteína sea semejante a la de la mioglobina, es decir, su capacidad de unirse al O2 reversiblemente procede de las configuraciones terciarias semejantes de sus respectivas cadenas peptídicas.
Ha sido demostrado que la secuencia aminoacídica (la estructura primaria) de una cadena polipeptídica de una proteína oligómera codifica no solamente su estructura terciaria, sino también la geometría de los centros de contacto o de unión, a los que se enlaza otro protómero codificado específicamente. La información codificada en la secuencia aminoacídica resulta, por tanto, significativa en dos, tres o más niveles de organización estructural: secundario, terciario y cuaternario.
Resulta conveniente resaltar que la conformación de una cadena polipeptídica viene determinada por el tamaño, la forma y la polaridad de los grupos R de sus aminoácidos, así como por la secuencia aminoacídica. Los grupos R se hallan lo bastante próximos para que puedan interactuar entre si, o con el disolvente, de manera tal que limitan la libre rotación de los enlaces sencillos del esqueleto de la cadena peptídica.
Otras limitaciones en la conformación de la cadena polipeptídica son las que imponen la naturaleza rígida y casi planar del enlace peptídico y la existencia de enlaces cruzados S S covalentes.
Trasformaciones químicas de las proteínas
La compleja configuración de una proteína es muy delicada; puede modificarse por agentes químicos o por medios físicos, a este cambio se le llama "Desnaturalización". Así, al añadir alcohol a la clara de huevo ésta se coagula igual que al calentarla. La Caseína, proteína contenida en la leche, se coagula en un medio ácido; por lo que bastan unas gotas de jugo de limón para cortar la leche, o bien esperar a que se produzca suficiente ácido en la misma leche para que se corte.
Las pezuñas y huesos animales (formados principalmente por la proteína llamada Colágeno) se disuelven por calentamiento con Álcalis para formar la Cola. La leche, además de coagularse por medio de un ácido, también lo hace por calor (flanes y natillas) y la carne, por su parte, encoge al cocerla por el colapso de la estructura del colágeno. Los fenómenos anteriores resultan de cambios en la configuración de las proteínas constituyentes.
Las soluciones de proteínas pueden formar películas y esto explica por qué la clara de huevo puede ser batida. La película formada retiene el aire, pero si uno la bate excesivamente la proteína se "desnaturaliza " y se rompe la película.
La carne, junto con muchas otras proteínas, contiene colágeno, el cual con la temperatura se transforma en otra proteína más suave, soluble en agua caliente, la gelatina. Nuevamente, como en el caso del azúcar hay muchos tipos de gelatinas; éstas tienen masas moleculares de 100 000, en contraste con los valores de 300 000 a 700 000 del colágeno.
La desnaturalización de las proteínas de la carne se logra también con un ácido (jugo de limón, vinagre, salsa de tomate) como se comprueba al "marinar" las carnes o el Cebiche de pescado. Escabechar es, al menos químicamente, lo mismo que marinar: una desnaturalización ácida de proteínas que ablanda la carne y además la sazona.
Al igual, que los carbohidratos las proteínas pueden descomponerse; dan lugar a peptonas, polipéptidos, aminoácido, amoniaco, nitrógeno y unos compuestos muy olorosos como los mercaptanos, el 3 metil-indol, también conocido como escatol, la putrescina y el ácido sulfhídrico.
Funciones
Funciones estructurales
Ciertas partes del organismo animal, que sirven de sostén y protección amuchos tejidos están formadas por proteínas, ejemplo de las cuales son:
- La queratina, que se encuentra en las uñas, pezuñas, cuernos, lana, piel, plumas, caparazón de los moluscos
- La elastina, se encuentra en los ligamentos.
- El colágeno, en los tendones.
- La fibroína, en la seda.
Funciones energéticas
Ésta es una de las funciones secundarias que desempeñan las proteínas pero que es necesario tenerla en cuenta porque son capaces de liberar 4 kcal/g al ser metabolizadas. En casos extremos, en que el organismo no disponga de otros alimentos energéticos, puede consumir sus propios tejidos y utilizar las proteínas de éstos como fuente de energía.
Funciones específicas
- Las nucleoproteínas, que se encuentran en el núcleo de las células, son responsables de la reproducción y de la transmisión de las características hereditarias.
- Las enzimas, que están en todos los tejidos y actúan como catalizadores biológicos en las reeacciones metabólicas.
- Las cromoproteínas, que en su mayoría sirven para transportar gases, como la hemeglobina, en la sangre de los vertebrados, que transporta el oxígeno desde los pulmones hasta las células de los tejidos.
Varias hormonas, vacunas, antibióticos y virus, que son sustancias de gran actividad biológica, están formados por proteínas.
Fuentes
- Córdova Frunz, José Luis (2006). La química y la cocina. En la Ciencia para todos. Disponible en [1]
- Zumbado Fernández, Héctor (2004). Análisis químico de los alimentos: métodos clásicos. Ciudad de La Habana: Editorial Universitaria (Cuba). -- ISBN 978-959-16-0253-4 -- 439 pág. 3,755 Kb. Disponible en: [2]
- Manual de química orgánica para estudiantes de Ciencias Agropecuarias. Dr.C María Irene Balbín y col.
- Libro Química II
Contacto
Puebla
72000 2228616167 ivonvickyac1@gmail.com

